Tuvimos la oportunidad de dialogar con los Dres. Alejandro Beresñak y Facundo Díaz, del área «Innovación y Desarrollo» del Servicio de Diagnóstico por Imágenes del Hospital Italiano y con el Dr. Nicolás Minatta, miembro del staff del Servicio de Oncología conducido por el Dr. Sergio Specterman, del mismo hospital.
El Hospital creó el Programa de Inteligencia Artificial en Salud (pIASHIBA) que tiene base en el Departamento de Informática en Salud.
Es un equipo interdisciplinario compuesto por: bioingenieros, implementadores, ingenieros, desarrolladores y médicos. Dentro de los médicos hay especialistas en informática en salud y en diagnóstico por imágenes. Esta iniciativa fue impulsada por los Dres. Daniel Luna (Jefe del Departamento de Informática en Salud) y Martín Rabellino (Jefe del Servicio de Diagnóstico por Imágenes), con una visión orientada hacia los desarrollos propios.
La bioingeniera Candelaria Mosquera nos puso al tanto de algunas de las herramientas empleadas en las nuevas ciencias computacionales aplicadas a la medicina.
¿En qué consiste la medicina personalizada o «medicina de precisión»?
AB: La medicina de precisión (PM) se refiere al uso de la información genética individual de una persona para diseñar estrategias para la detección, tratamiento y/o prevención de una enfermedad. Los avances en la genómica han llevado al consenso entre científicos y clínicos de que PM tiene el potencial de revolucionar la práctica médica, especialmente en oncología. El objetivo de PM es delinear los subtipos de pacientes según sus mecanismos de enfermedad y su respuesta particular a las terapias. Se basa en el conocimiento emergente de que algunas variaciones moleculares subyacentes son responsables de ciertas enfermedades y que a su vez estas pueden ser manejadas por ciertas terapias. Esto es una desviación del enfoque de «talla única» (one size fits for all) en el que a los pacientes con enfermedades similares se les administra el mismo tipo y dosis de medicamento sin saber quién podría beneficiarse más o, a la inversa, quién podría sufrir toxicidad y reacciones adversas a los medicamentos.
El objetivo de PM es asegurar que los pacientes correctos reciban la dosis correcta y el tratamiento correcto en el momento adecuado. Las imágenes médicas, por su naturaleza, siempre han intentado ser personalizadas y parecen ser esenciales en el futuro de la medicina personalizada. Los biomarcadores de imágenes se pueden utilizar para la estratificación de los pacientes en términos de estadificación o intervención. Las imágenes médicas también serán vitales en la planificación personalizada de la terapia, la administración y el seguimiento del efecto del tratamiento y la progresión de la enfermedad.
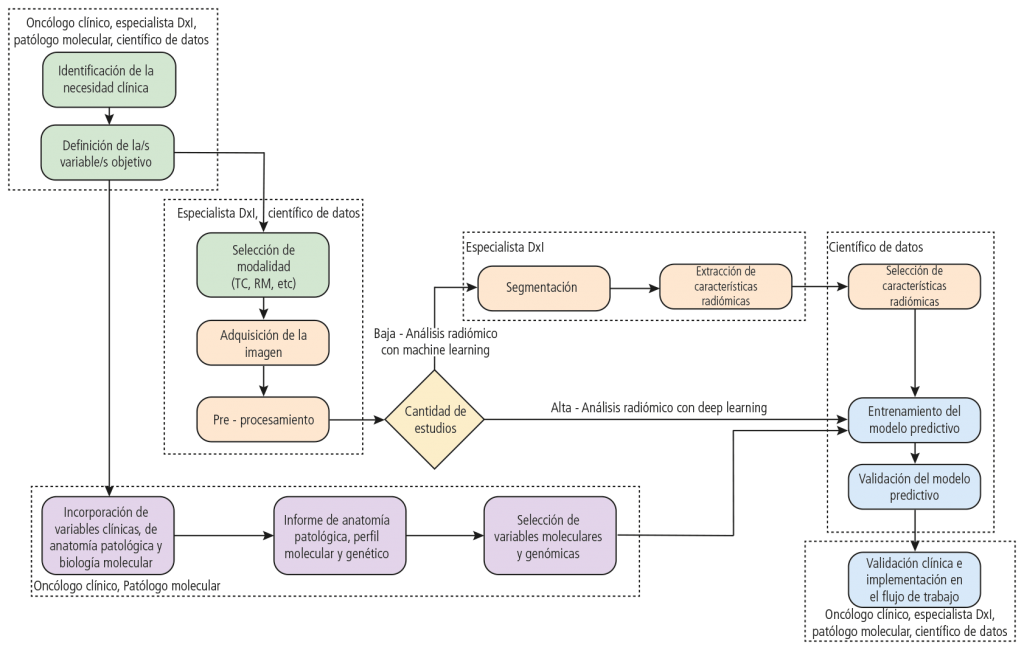

Pipeline para el desarrollo de una firma radiómica
La radiómica se basa en el desarrollo de modelos computacionales, denominados «firmas radiómicas», que intentan abordar las necesidades clínicas no satisfechas, principalmente en el campo de las imágenes oncológicas
Una tubería de investigación radiómica (pipeline) es un flujo dde trabajo que comprende varias fases que incluyen 1) definir la pregunta clínica y enfocarse en la cohorte de pacientes apropiada, 2) identificar las modalidades de imagen relevantes para el análisis radiómico, 4) optimizar y estandarizar los protocolos de adquisición, 4) aplicar el procesamiento previo antes de la imagen análisis, 5) realizar la segmentación de la lesión en las imágenes, 6) extraer características de imágenes profundas o artesanales, 7) reducir la dimensionalidad de los datos generados por los métodos de selección de características y finalmente 8) entrenar y validar el modelo radiómico (Fig. 1 ).
¿Qué son los biomarcadores?
FD: Los biomarcadores (o marcadores biológicos) son «características y signos médicos que se miden y evalúan objetivamente como un indicador de procesos biológicos normales, procesos patógenos o respuestas farmacológicas. Pueden medirse de manera precisa y reproducible». Estos biomarcadores son, por lo tanto, importantes en la identificación de la clasificación de subpoblaciones de pacientes que podrían estar predispuestos a una enfermedad o responder a una terapia. Como consecuencia del Proyecto del Genoma Humano y el proyecto del Mapa Internacional de Haplotipos, más de 1300 loci para aproximadamente 221 enfermedades y rasgos están disponibles a través del estudio validado de la Asociación del Genoma. A través de estas asociaciones de biomarcadores, es posible predecir el riesgo de que las personas desarrollen una enfermedad, como el cáncer. Los biomarcadores se clasifican en términos generales como marcadores pronósticos, marcadores predictivos o ambos. Los marcadores de pronóstico proporcionan información sobre una característica del paciente que tiene el potencial de afectar el curso o el resultado de la enfermedad. Por otro lado, los marcadores predictivos se refieren a las características del paciente que pueden predecir la probabilidad de un paciente de beneficiarse de un tratamiento.
Existen biomarcadores cuantitativos que se extraen a partir de las imágenes médicas. Estos biomarcadores de imagen dependen de:
• Protocolos de adquisición de imágenes anatómicas, funcionales y moleculares.
• Análisis de datos.
• Métodos de visualización.
• Informes estructurados.
Estas características permiten la validación de métricas derivadas de imágenes obtenidas con precisión y con parámetros anatómicamente y fisiológicamente relevantes, incluida la respuesta al tratamiento y el resultado, y el uso de dichas métricas en la investigación y la atención al paciente.
Qué es la radiómica?
FD: En las últimas décadas, el campo del análisis de imágenes médicas ha crecido exponencialmente, con la aparición de nuevas herramientas para reconocimiento de patrones y un aumento en el tamaño de los datasets. Estos avances han facilitado el desarrollo de técnicas de alto rendimiento para la extracción de datos cuantitativos, convirtiendo las imágenes en información minable y permitiendo el subsiguiente análisis de estos datos para brindar soporte a la decisión clínica.
Dentro del estudio de biomarcadores por imágenes, se destaca el campo de radiómica, o análisis radiómico, en referencia a otros campos que extraen información estructurada de la biología como la genómica y la proteómica. Se contrapone a la práctica tradicional de tratar las imágenes médicas como meras imágenes demostrativas destinadas únicamente a interpretación visual. La radiómica contiene estadística de primer, segundo y alto orden. Estos datos se pueden combinar con otros datos del paciente y son minados con herramientas informáticas sofisticadas para desarrollar modelos que potencialmente podrían mejorar la precisión diagnóstica, prognóstico y predictiva . En los últimos dos años se han publicado numerosos trabajos que aplican radiómica en imágenes pulmonares de pacientes diagnosticados con NSCLC, incluyendo información valiosa para pacientes con mutación de EGFR.
¿Cómo funciona la inteligencia artificial en el desarrollo de biomarcadores de imágenes en cáncer?
AB: El programa de Inteligencia Artificial en Salud (pIASHIBA) consiste en un conjunto de proyectos de innovación para desarrollar herramientas de inteligencia artificial (IA) aplicadas a la salud humana. El objetivo final de cada proyecto es el desarrollo de un modelo computacional que brinde soporte a la decisión clínica, en este caso a la ONCOLOGÍA DE PRECISIÓN:
Uno de los principales desafíos en oncología es conocer de antemano si un tratamiento funcionará eficaz y prolongadamente, es decir conocer lo que llamamos un valor predictivo; por ejemplo si un paciente con diagnóstico de cáncer de pulmón, tiene una mutación en el exón 19 ó 21 del receptor de factor de crecimiento epidérmico (EGFR) sabemos de antemano que un inhibidor de tirosina quinasa contra EGFR es notablemente más eficaz que la quimioterapia. Si queremos profundizar este concepto y llevarlo a la práctica de la mano de la inteligencia artificial, el análisis computacional cuantitativo de las imágenes de una Tomografía Computada, por ejemplo, intentará proporcionar una firma radiómica tal que podamos conocer respuestas fundamentales antes del inicio de la terapéutica.
Qué es y cómo se consigue una firma radiómica?
AB: La radiómica se basa en el desarrollo de modelos computacionales, denominados «firmas radiómicas», que intentan abordar las necesidades clínicas no satisfechas, principalmente en el campo de las imágenes oncológicas.
Una tubería de investigación radiómica (pipeline) es un flujo de trabajo que comprende varias fases que incluyen 1) definir la pregunta clínica y enfocarse en la cohorte de pacientes apropiada, 2) identificar las modalidades de imagen relevantes para el análisis radiómico, 3) optimizar y estandarizar los protocolos de adquisición, 4) aplicar el procesamiento previo antes de la imagen análisis, 5) realizar la segmentación de la lesión en las imágenes, 6) extraer características de imágenes profundas o artesanales, 7) reducir la dimensionalidad de los datos generados por los métodos de selección de características y finalmente 8) entrenar y validar el modelo radiómico (Fig. 1).
¿Qué respuestas espera el oncólogo?
NM: Acorde a nuestro enfoque radiogenómico, las respuestas esperadas serían las siguientes:
1- Determinar cuál tratamiento es más eficaz entre distintos inhibidores de tirosina quinasa (TKI) del gen EFGR.
2- Cuánto tiempo durará dicho tratamiento?
3- Integrar distintos mecanismos de resistencia.
4- Detectar cambios no detectables al ojo humano acerca de procesos previos a la progresión clínica y/o por imágenes que podrían implicar cambios en la conducta.
5- Evitar continuar tratamientos que están fracasando en tiempo real.
6- Combinar con otras técnicas de diagnóstico preciso como biopsia líquida para aumentar la eficacia del diagnóstico de situación oncológica.
7- Programar con tiempo adecuado una nueva biopsia de tejido en el momento indicado para conocer mecanismos de resistencia y entregar el mejor tratamiento en tiempo oportuno con el objetivo de disminuir la toxicidad farmacológica y económica, incrementando la adherencia terapéutica y la supervivencia de los pacientes.
¿Cómo se aplica la radiómica a la oncología?
NM: Por un lado, identificando firmas radiómicas que permitan establecer diagnóstico preciso (en el futuro podría evitar incluso realizar un biopsia de tejidos), predecir por ejemplo si una lesión evidenciada en una tomografía es benigna o maligna, identificar cuál es el mejor tratamiento, con esto disminuir los costos asociados, incrementar la efectividad así como también la adherencia de fármacos, predecir con mayor precisión una evolución clínica-oncológica.
La radiómica es el proceso de extracción de estos datos mediante análisis computacionales mientras que la radiogenómica es el análisis conjunto de los datos extraídos con los datos genómicos del tumor (patrones de expresión genómica y de mutaciones genéticas).
¿Qué herramientas de imágenes se utilizan en Oncología de precisión?
FD: Los criterios de evaluación de la respuesta en tumores sólidos (RECIST) son parte de un sistema que se utiliza para ayudar a estandarizar la evaluación radiológica de la respuesta de los tumores al tratamiento sistémico como la quimioterapia o la terapia dirigida en ensayos clínicos. La eficacia de los nuevos medicamentos no solo se determina midiendo la supervivencia general de los pacientes, sino también midiendo el crecimiento o la regresión de los tumores en los estudios de imágenes. Esta información se usa para medir el tiempo hasta la progresión (el tiempo desde el inicio del tratamiento hasta la progresión de la enfermedad) y la supervivencia sin progresión (el tiempo desde el inicio del tratamiento hasta la progresión o la muerte por cualquier causa). RECIST suena simple. En el estudio de imagen de referencia respectivo, se seleccionan las llamadas lesiones «diana» y se mide su tamaño. Luego, cuando el paciente regresa después del tratamiento, estas mismas lesiones son reidentificadas y medidas nuevamente. El tamaño de la lesión objetivo basal y de seguimiento se compara para determinar si el tumor se achicó, permaneció igual o progresó con el tratamiento. RECIST regula cuántas lesiones objetivo se pueden usar y cómo medir estas lesiones y prescribe los valores umbral en los que se basa nuestra categorización de la respuesta. Aplicado a la inmunoterapia se denomina i-RECIST
¿Cómo se relaciona la radiómica con la medicina de precisión?
CM: En un contexto donde la industria de la salud genera datos en mayor cantidad y de mayor variedad, la tendencia es buscar interrelacionar las distintas fuentes de datos para lograr un análisis aún más rico. El objetivo de la medicina de precisión es lograr cruzar todos los datos asociados a un paciente, aplicando modelos de datos que tengan en cuenta información obtenida de todas las distintas fuentes de datos de la salud: historia clínica, demografía, estudios de laboratorio, estudios de imagen, y estudios genéticos, entre otros.
En este marco, surge la necesidad de estudiar las imágenes médicas desde un punto de vista cuantitativo, que es el objetivo de la radiómica. Consiste en lograr una extracción automática y a gran escala de características cuantitativas a partir de imágenes médicas, convirtiendo la imagen en datos minables, que puedan ser analizados con métodos estadísticos y computacionales para generar herramientas de soporte a la decisión.
El proceso de extracción de datos radiómicos consiste en transformar la imagen en una serie de variables predictivas, conocidas como radiomic features o características radiómicas, que sintetizan la información contenida en la imagen. El análisis radiómico buscará encontrar una relación entre las características radiómicas y variables outcome de interés, referentes a un diagnóstico clínico, anatomopatológico, o a un pronóstico o respuesta terapéutica. Las características radiómicas que muestran ser relevantes para indicar un estado biológico se conocen como biomarcadores de imagen.
El uso de la radiómica implica una serie de pasos, que se adaptan según características del problema, que incluyen por ejemplo la modalidad de imagen o el objetivo de predicción. A grandes rasgos, la primer etapa consiste en preparar un dataset adecuado, homogéneo y estandarizado, y la segunda etapa en extraer features con técnicas de radiómica y analizarlas con métodos de Machine Learning. Por supuesto, siempre esto es seguido de una etapa de validación clínica.
¿Cuáles son las aplicaciones prácticas de la radiómica y la oncología de precisión?
AB: nosotros estamos realizando trabajos de investigación en el campo oncológico del cáncer de pulmón,melanoma, , cáncer de riñon y cáncer colorectal de cara a contribuir con la toma de decisiones de la mano de la inteligencia artificial, principalmente con el uso de firmas radiómicas con los objetivos de implementar métodos más precisos de diagnóstico y pronóstico oncológico así como también, conocer el grado de respuesta a distintos tratamientos que modifiquen la calidad de vida de los pacientes.
¿Qué se avecina en el futuro?
NM: Este creciente y rápido incremento en el conocimiento de las distintas aplicaciones de inteligencia artificial en cáncer traerá beneficios en niveles insoslayables en el corto plazo. Adaptar nuestra capacidad instalada al servicio del conocimiento e invertir en ciencia y tecnología nos dará herramientas para incrementar la precisión y eficacia de nuestros tratamientos.
Citas:
Eur J Radiol. 2019 May;114:128-135. doi: 10.1016/j.ejrad.2019.01.003. Epub 2019 Mar 20.PMID: 31005162
Eur J Nucl Med Mol Imaging. 2019 Apr;46(4):878-888. doi: 10.1007/s00259-018-4250-6. Epub 2019 Jan 13.
Cancer Imaging. 2019 Feb 27;19(1):11. doi: 10.1186/s40644-019-0197-5. PMID: 30813956
-Eur J Cancer. 2019 Oct;120:107-113. doi: 10.1016/j.ejca.2019.07.023. Epub 2019 Sep 9. PMID: 31514107
Lung Cancer. 2018 Oct;124:6-11. doi: 10.1016/j.lungcan.2018.07.023. Epub 2018 Jul 20. PMID: 30268481



