OAK BROOK, Illinois — Un modelo de Deep Learning funciona al nivel de un radiólogo abdominal en la detección de cáncer de próstata clínicamente significativo en la resonancia magnética, según un estudio publicado hoy en Radiology (revista de la RSNA). Los investigadores esperan que el modelo pueda usarse como complemento para los radiólogos para mejorar la detección del cáncer de próstata.

El cáncer de próstata es el segundo cáncer más común en los hombres en todo el mundo. Los radiólogos suelen utilizar una técnica que combina diferentes secuencias de resonancia magnética (llamada resonancia magnética multiparamétrica) para diagnosticar el cáncer de próstata clínicamente significativo. Los resultados se expresan a través del Sistema de datos e informes de imágenes de próstata versión 2.1 (PI-RADS), un enfoque estandarizado de interpretación y generación de informes. Sin embargo, la clasificación de lesiones mediante PI-RADS tiene limitaciones.
“La interpretación de la resonancia magnética de próstata es difícil”, afirmó el autor principal del estudio, el Dr. Naoki Takahashi, del Departamento de Radiología de la Clínica Mayo en Rochester, Minnesota. “Los radiólogos con más experiencia tienden a tener un mejor rendimiento diagnóstico”.
La aplicación de algoritmos de inteligencia artificial (IA) a la resonancia magnética de próstata ha demostrado ser prometedora para mejorar la detección del cáncer y reducir la variabilidad del observador, que es la inconsistencia en la forma en que las personas miden o interpretan las cosas que puede llevar a errores. Sin embargo, una desventaja importante de los enfoques de IA existentes es que un radiólogo o patólogo debe anotar la lesión (agregar una nota o explicación) en el momento del desarrollo inicial del modelo y nuevamente durante la reevaluación y el reentrenamiento del modelo después de la implementación clínica.
“Los radiólogos anotan las lesiones sospechosas en el momento de la interpretación, pero estas anotaciones no están disponibles de forma rutinaria, por lo que cuando los investigadores desarrollan un modelo de aprendizaje profundo, tienen que volver a dibujar los contornos”, dijo el Dr. Takahashi. “Además, los investigadores tienen que correlacionar los hallazgos de las imágenes con el informe patológico al preparar el conjunto de datos. Si hay múltiples lesiones presentes, puede que no siempre sea posible correlacionar las lesiones en la resonancia magnética con sus resultados patológicos correspondientes. Además, este es un proceso que requiere mucho tiempo”.
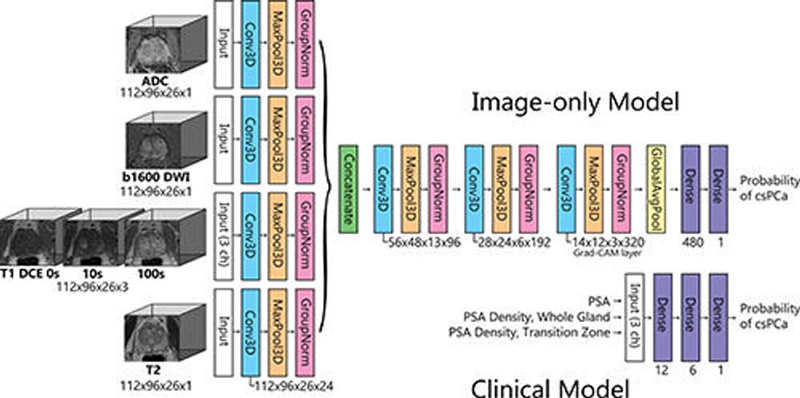
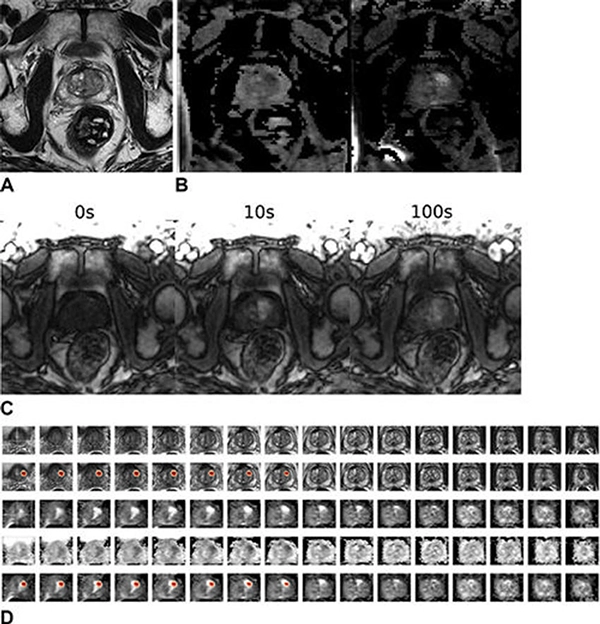
El Dr. Takahashi y sus colegas desarrollaron un nuevo tipo de modelo de aprendizaje profundo para predecir la presencia de cáncer de próstata clínicamente significativo sin requerir información sobre la ubicación de la lesión. Compararon su desempeño con el de los radiólogos abdominales en un grupo grande de pacientes sin cáncer de próstata clínicamente significativo conocido que se sometieron a una resonancia magnética en múltiples sitios de una sola institución académica. Los investigadores entrenaron una red neuronal convolucional (CNN), un tipo sofisticado de IA que es capaz de discernir patrones sutiles en imágenes más allá de las capacidades del ojo humano, para predecir el cáncer de próstata clínicamente significativo a partir de una resonancia magnética multiparamétrica.
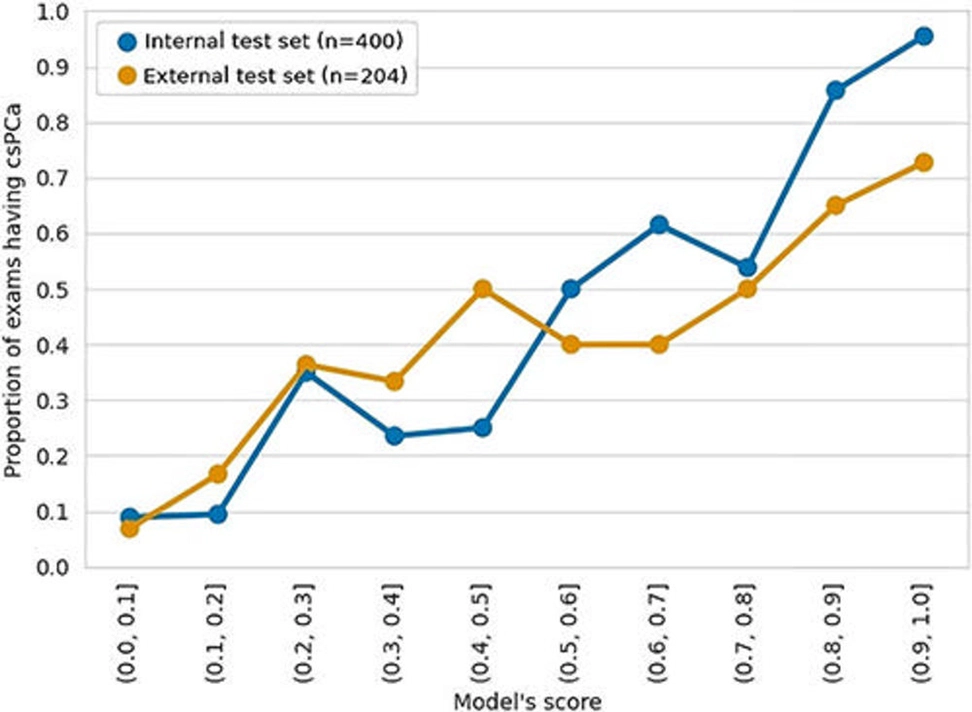
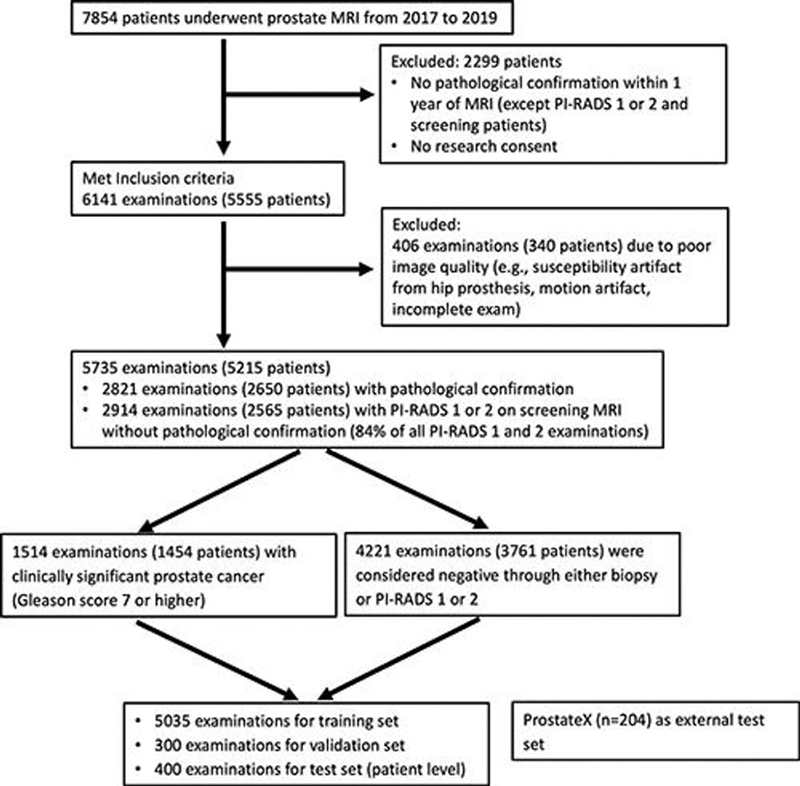
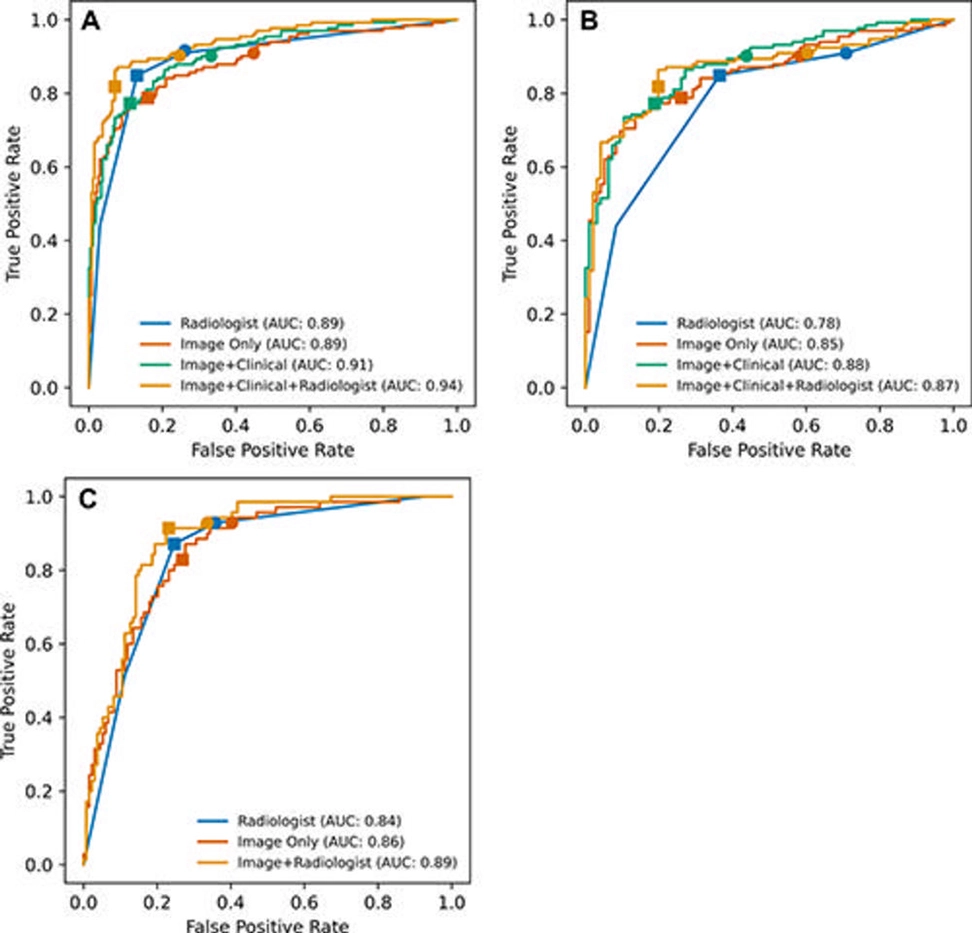
Entre 5.735 exámenes realizados a 5.215 pacientes, 1.514 exámenes mostraron cáncer de próstata clínicamente significativo. Tanto en el conjunto de pruebas internas de 400 exámenes como en un conjunto de pruebas externas de 204 exámenes, el rendimiento del modelo de aprendizaje profundo en la detección de cáncer de próstata clínicamente significativo no fue diferente al de los radiólogos abdominales experimentados. Una combinación del modelo de aprendizaje profundo y los hallazgos del radiólogo tuvieron un mejor rendimiento que los radiólogos solos en los conjuntos de pruebas internas y externas.
Dado que el resultado del modelo de aprendizaje profundo no incluye la ubicación del tumor, los investigadores utilizaron algo llamado mapa de activación de clase ponderado por gradiente (Grad-CAM) para localizar los tumores. El estudio demostró que, en el caso de los exámenes verdaderamente positivos, Grad-CAM destacó de manera consistente las lesiones de cáncer de próstata clínicamente significativas.
El Dr. Takahashi ve el modelo como un asistente potencial para el radiólogo que puede ayudar a mejorar el rendimiento diagnóstico en la resonancia magnética a través de mayores tasas de detección de cáncer con menos falsos positivos.

“No creo que podamos utilizar este modelo como una herramienta de diagnóstico independiente”, afirmó el Dr. Takahashi. “En cambio, la predicción del modelo puede utilizarse como complemento en nuestro proceso de toma de decisiones”.
Los investigadores han seguido ampliando el conjunto de datos, que ahora duplica el número de casos utilizados en el estudio original. El siguiente paso es un estudio prospectivo que examina cómo interactúan los radiólogos con la predicción del modelo.
“Nos gustaría presentar los resultados del modelo a los radiólogos y evaluar cómo lo utilizan para la interpretación y comparar el rendimiento combinado del radiólogo y el modelo con el del radiólogo solo a la hora de predecir el cáncer de próstata clínicamente significativo”, dijo el Dr. Takahashi.


