Dr. VANRELL, Andrés Julián. – Jefe de División Diagnóstico por Imágenes
Dr. PERALTA, Juan. Médico de planta. – Sector Tomografía Computada Multislice.
Dr. SAEZ, Andres. Médico de planta. – Sector Tomografía Computada Multislice.
Dr. BASILIS, José María. – Médico de planta. – Sector Ecografía y Doppler.
Hospital General de Agudos Dr. E Tornú. GCBA.Argentina
Correspondencia: Dr. Andrés J.Vanrell – [email protected]
Introducción
Paciente masculino de 54 años con antecedente de EPOC y TBC. Presenta hemoptisis, fiebre y disnea de 10 días de evolución.
Hallazgos Imagenológicos
Se realizó tomografía computada multidetector (TCMD) de tórax sin contraste, donde se evidencia a nivel del vértice pulmonar izquierdo una cavidad de paredes gruesas de 40 x 51 mm aproximadamente dentro de la cual se observa imagen de densidad de partes blandas lobulada y heterogenea con algunas imágenes aéreas internas, la misma se encuentra rodeada y separada de su pared anterior por una lámina aerea. (Figuras 1, 2, 3 y 4).
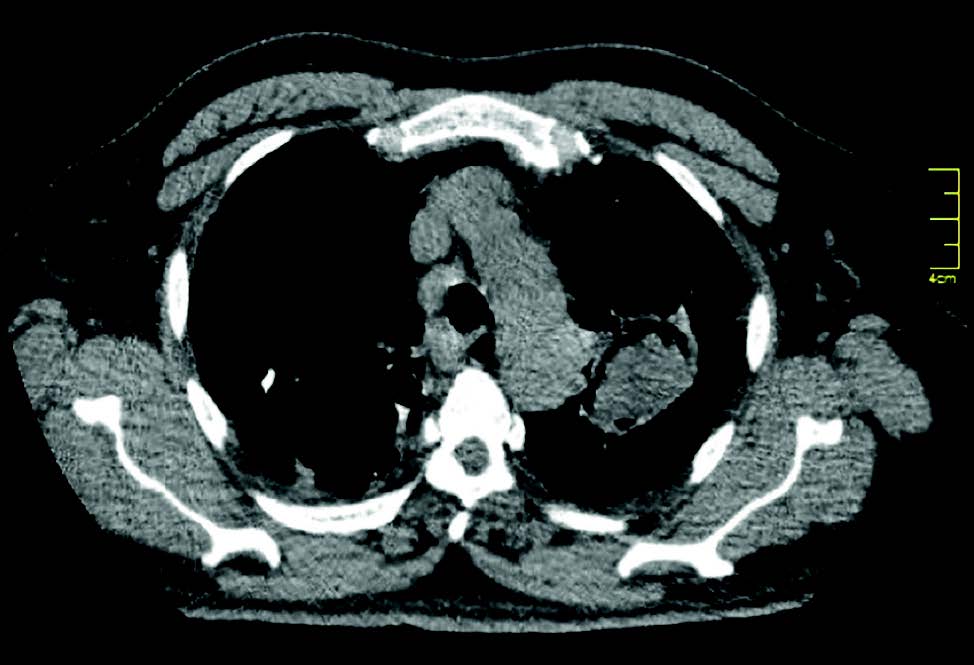

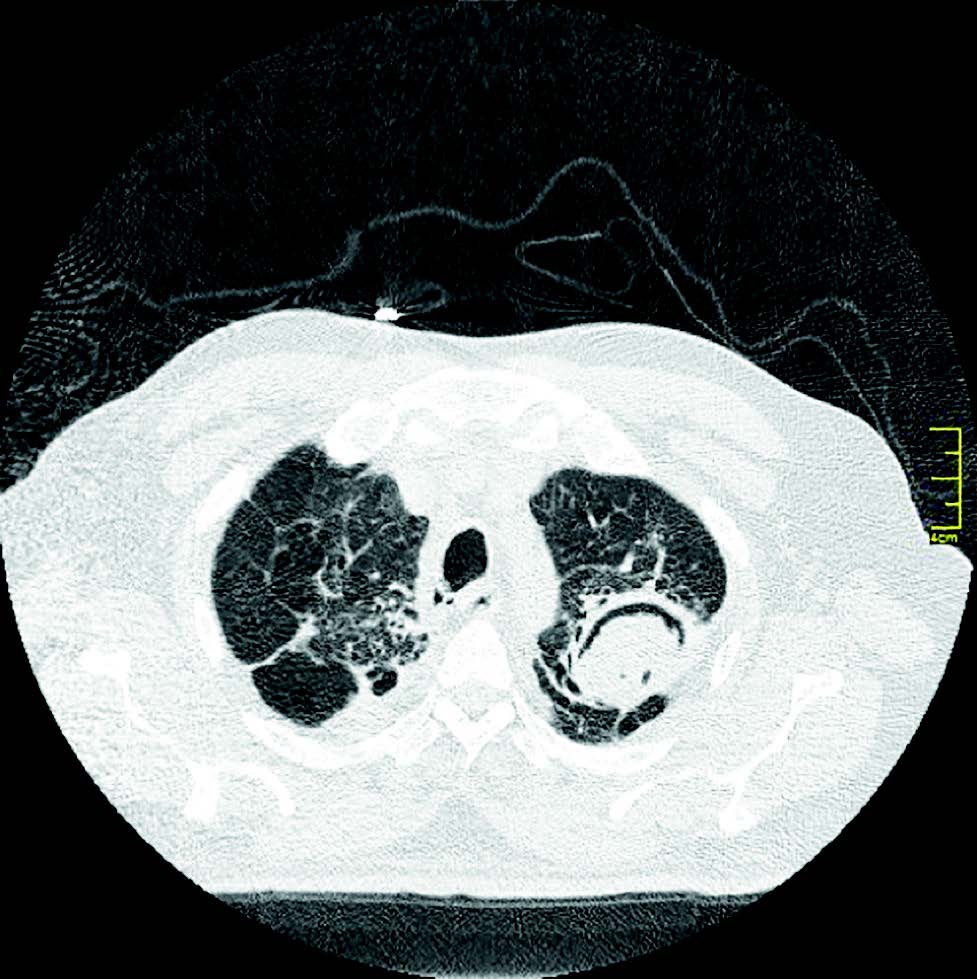

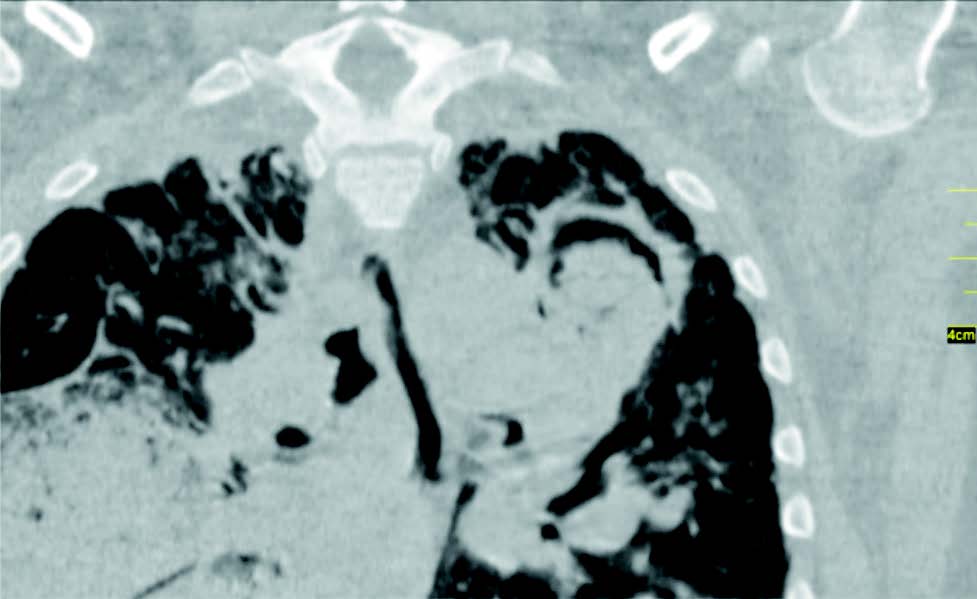

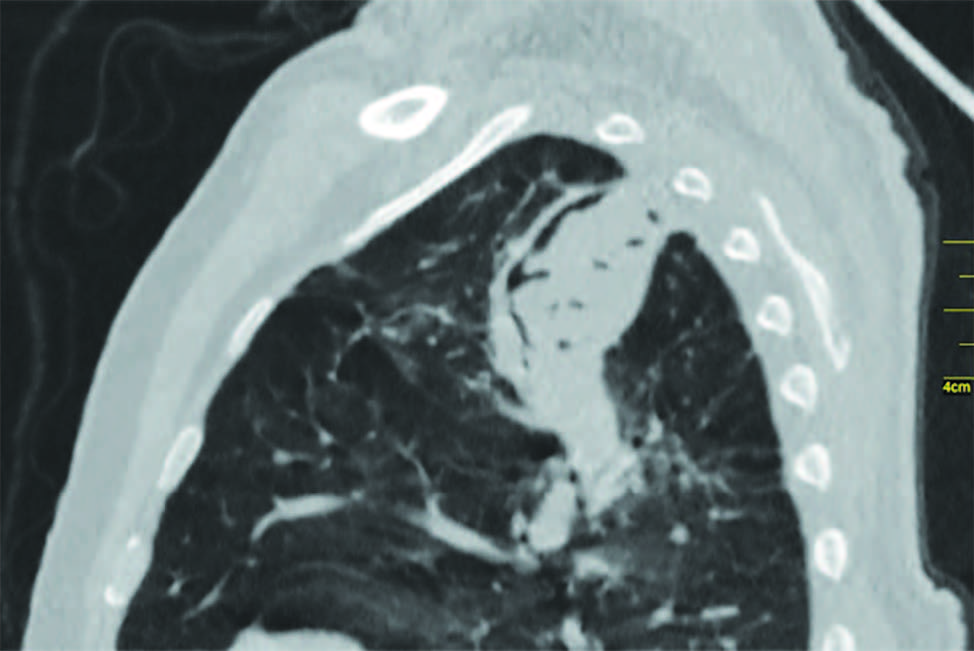

Se observa en lóbulo inferior derecho consolidación con broncograma aéreo asociada a vidrio esmerilado, que podría corresponder a proceso inflamatorio-infeccioso.
Discusión
El aspergiloma es una infección saprofítica por Aspergillus en un huésped inmunocompetente, por tanto no invade los tejidos sino que únicamente produce una reacción tisular leve. Desde el punto de vista anatomopatológico, un aspergiloma es un conglomerado de hifas, mucina, fibrina y células inflamatorias en el interior de una cavidad pulmonar preexistente causada por distintas enfermedades, las más frecuentes la tuberculosis, sarcoidosis y la enfermedad pulmonar obstructiva crónica (EPOC) tipo enfisema. También es posible encontrarlos en pacientes con bronquiectasias, neumoconiosis, fibrosis pulmonar, neoplasias, quistes broncogénicos, neumatoceles y en cavidades posquirúrgicas. Normalmente son únicos y tienen predilección por los lóbulos superiores, probablemente por las altas concentraciones de oxígeno y la tendencia a la cavitación en los ápices pulmonares.
Sí bien los pacientes con aspergilomas pueden permanecer asintomáticos y diagnosticarse incidentalmente, la manifestación clínica más frecuente es la hemoptisis, que puede ser mortal en aproximadamente el 5% de los pacientes.
La TCMD muestra una masa sólida redondeada que ocupa parcialmente el interior de una cavidad pulmonar, separada de sus paredes por un anillo de aire. Esta característica radiológica, que se conoce como el signo de la semiluna aérea, es típica de los aspergilomas maduros. En fases más precoces de desarrollo del aspergiloma, el primer signo puede ser el engrosamiento de la pared de la cavidad, o de la pleura adyacente. La bola de hongos puede ser móvil y obtener imágenes en decúbito prono permite demostrar un cambio de posición.
El diagnóstico diferencial de las lesiones que pueden producir el signo de la semiluna incluye las formas de aspergilosis necrosante e invasiva, el hematoma, las neoplasias, los abscesos, el quiste hidatídico y la granulomatosis de Wegener.
Es posible encontrar también formas inmaduras de aspergiloma en las cuales los filamentos del hongo están entrelazados, atrapan burbujas de aire y dan lugar a una reticulación irregular de aspecto espongiforme que rellena una cavidad. Estas estructuras ramificadas pueden permanecer estables o confluir hasta formar la bola de hongos madura.
Aunque el aspergiloma representa una forma de colonización benigna, en determinadas circunstancias puede ser el origen de una aspergilosis necrosante o de una aspergilosis invasiva.
Conclusión
El aspergiloma es una infección saprofítica en un huésped inmunocompetente y se muestra en TCMD como una masa sólida que ocupa parcialmente el interior de una cavidad pulmonar y que queda separada de sus paredes por un anillo de aire, característica radiológica conocida como el signo de la semiluna aérea.
La TC de tórax es la herramienta de elección para establecer el diagnóstico.
Bibliografía
1. Stevens DA, Kan VL, Judson MA, Morrison VA, Dummer S, Denning DW, et al. Practice guidelines for diseases caused by Aspergillus. Infectious Diseases Society of America. Clin Infec Dis. 2000;30:696-709.
2. Franquet T, Müller NL, Giménez A, Domingo P, Plaza V, Bordes R. Semiinvasive pulmonary aspergillosis in chronic obstructive pulmonary disease: Radiologic and pathologic findings in nine patients. AJR Am J Roentgenol. 2000;174:51-6.
3. Kousha M, Tadi R, Soubani AO. Pulmonaryaspergillosis: A clinicalreview. EurResp Rev. 2011;20:156-74.
4. Franquet T, Müller NL, Giménez A, Guembe P, de la TorreJ, Bagué S. Spectrum of pulmonary aspergillosis: Histologic,clinical, and radiologic findings. Radiographics. 2001;21:825-37.
5. Soubani AO, Chandrasekar PH. The clinical spectrum of pulmonary aspergillosis. Chest. 2002;121:1988-99.
6. Thompson BH, Stanford W, Galvin JR, Kurihara Y. Varied radiologic appearances of pulmonary aspergillosis. Radiographics.1995;15:1273-84.
7. Roberts CM, Citron KM, Strickland B. Intrathoracic aspergilloma: Role of CT in diagnosis and treatment. Radiology. 1987;165:123-8.
8. Passera E, Rizzi A, Robustellini M, Rossi G, Della Pona C, Massera F, et al. Pulmonary aspergilloma: Clinical aspects and surgical treatment outcome. Thorac Surg Clin. 2012;22: 345-61.
9. Greene R. The radiological spectrum of pulmonary aspergillosis. Med Mycol. 2005;43:147-54.
10. Kang EY, Kim DH, Woo OH, Choi JA, Oh YW, Kim CH. Pulmonary aspergillosis in immunocompetent hosts without underlying lesions of the lung: Radiologic and pathologic findings. AJR.2002;178:1395-9.
11. Yoon SH, Park CM, Goo JM, Lee HJ. Pulmonary aspergillosis in immunocompetent patients without air-meniscus sign and underlying lung disease: CT findings and histopathologic features. Acta Radiol. 2011;52:756-61.
12. Denning DW. Chronic form pulmonary aspergillosis. Clin Microbiol Infect. 2001;7:25-31.
13. Al-Alawi A, Ryan C, Flint J, Muller N. Aspergillus-related lung disease. Can Respir J. 2005;12:377-87.
14. Martinez S, Heyneman LE, McAdams HP, Rossi SE, Restrepo CS, Eraso A. Mucoid impactions: Finger-in-glove sign andother CT and radiographic features. Radiographics. 2008;28:1369-82.
15. Stevens DA, Schwartz HJ, Lee JY, Moskovitz BL, JeromeDC, Catanzaro A, et al. A randomized trial of itraconazole in allergic bronchopulmonary aspergillosis. N Engl J Med. 2000;342:756-62.
16. Horger M, Hebart H, Einsele H, Lengerke C, Claussen CD, Vonthein R, et al. Initial CT manifestations of invasive pulmonary aspergillosis in 45 non-HIV immunocompromised patients: Association with patient outcome? Eur J Radiol. 2005;55:437-44.
17. Walsh TJ, Anaissie EJ, Denning DW, Herbrecht R, Kontoyiannis DP, Marr KA, et al. Treatment of aspergillosis: Clinical practice guidelines of the Infectious Diseases Society of America. Clin Infect Dis. 2008;46:327-60.



